Einzeldomänenantikörper aus Kameliden finden zunehmend Verwendung in immunologischen Methoden der Analytik, Diagnostik und Forschung. Um den steigenden Bedarf und damit die Produktion von VHH-Antikörpern zu unterstützen, bietet der amerikanische Hersteller Jackson ImmunoResearch drei neue Sekundärantikörper für die spezifische Detektion und Quantifikation von Kameliden-Immunglobulinen an. Diese Gesamt-IgG sowie IgG2 und IgG3 spezifischen Antikörper erlauben eine genaue Unterscheidung von IgG-Subklassen in kameliden Serum und ermöglichen damit eine optimierte Herstellung von Nanobodies aus Schwere-Ketten-Antikörpern.
Im Serum von Kameliden (Alpakas, Lamas, Kamele, Dromedare, Vikunjas und Guanakos) finden sich drei IgG-Subklassen (IgG1, IgG2 und IgG3). Erfahren Sie hier mehr über die Struktur der Subklassen.
Detektion von kameliden IgG-Subklassen im Western Blot
Anti-Alpaka IgG (H+L) und Anti-Alpaka IgG2+IgG3 von Jackson ImmunoResearch eignen sich für die Identifizierung von Alpaka IgG und Lama IgG. Abbildung 1 und 2 zeigen den spezifischen Nachweis von Alpaka und Lama IgG-Subklassen im Westen Blot.
IgG-Subklassen wurden aus Serum isoliert (Protokoll nach Mass et al., 2007) und durch SDS-Page unter nicht-reduzierenden Bedingungen aufgetrennt. Die Immunglobuline wurden anschließend auf eine Nitrocellulose-Membran transferiert und mit HRP-konjugierten Sekundärantikörpern markiert (Verdünnung: 1: 20.000). Proteine wurden mit Chemilumineszenz Substrat nachgewiesen.
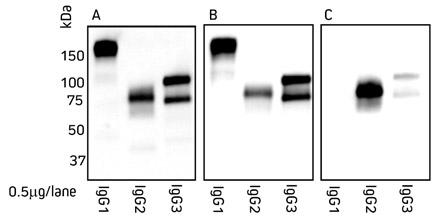
Blot A, Ziege IgG anti-Alpaka IgG (H+L)-HRPO 128-035-003; Blot B, Ziege IgG anti-Alpaka IgG (H+L)-HRPO [MinX Bo,Hu,Ms,Rb,Rt] 128-035-160; Blot C, Ziege IgG anti-Alpaka IgG2+IgG3-HRPO [MinX Bo,Hu,Ms,Rb,Rt] 128-035-229.
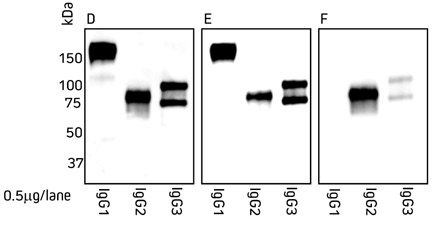
Blot D, Ziege IgG anti-Alpaka IgG (H+L)-HRPO 128-035-003; Blot E, Ziege IgG anti-Alpaka IgG (H+L)-HRPO [MinX Bo,Hu,Ms,Rb,Rt] 128-035-160; Blot F, Ziege IgG anti-Alpaka IgG2+IgG3-HRPO [MinX Bo,Hu,Ms,Rb,Rt] 128-035-229.
Zeitpunkt der Immunantwort optimal bestimmen
Für die Entwicklung von rekombinanten Nanobodies* werden Alpakas oder Lamas zunächst mit einem Antigen immunisiert. Eine anschließende Überwachung der Immunantwort ist nötig, um den idealen Zeitpunkt für die PBMC-isolation zu bestimmen.
Anti-Alpaka Sekundärantikörper von Jackson ImmunoResearch ermöglichen Gesamt-IgG von Schwere-Ketten Antikörpern im Kameliden Serum zu unterscheiden. Da während einer Immunisierung die Antikörperantwort von IgG1, IgG2 und IgG3 nicht immer zeitgleich erfolgt, wird somit die Ausbeute an Schwere-Ketten-Antikörpern produzierenden PBMCs optimiert.
Die Serokonversion (Antigenspezifische Antikörper-Titer) kann mittels ELISA oder Durchflusszytometrie/ FACS (Pardon et al., 2014) bestimmt werden. Mit Jackson Anti-Alpaka IgG (H+L) Sekundärantikörpern kann die prä-Immun und post-Immun Phase der Serokonversion überwacht werden. Wie in Abbildung 3 dargestellt, kann die Generierung von Schwere-Kette Antikörpern jedoch nicht eindeutig mit Gesamt-IgG Antikörpern bestimmt werden. Jackson Anti-Alpaka IgG2+IgG3 sind ideal für die Messung von Schwere-Ketten Antikörper im Serum. Hiermit kann der optimale Zeitpunkt für die PBMC-Isolation bestimmt und dadurch die Ausbeute an potentiellen Antikörpern für die VHH-Bibliothek erhöht werden.
Nach der Immunisierung mit einem Antigen wurden ELISAs für die Charakterisierung der spezifischen Antikörperreaktion verwendet. ELISA Platten wurden hierfür mit dem Zielantigen gecoated, Antiserum diente als primäre Antikörperquelle und Peroxidase-konjugierte Sekundärantikörper 128-035-160 oder 128-035-229 wurden jeweils zur Bestimmung von Gesamt-IgG oder der IgG2- und IgG3-Subklassen verwendet.
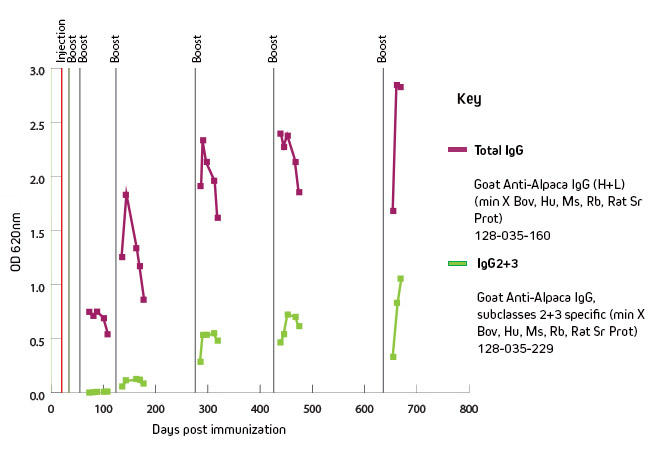
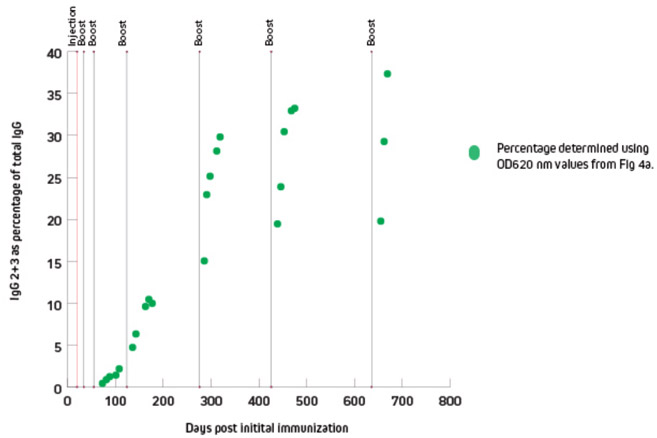
Der Gesamt-IgG-Titer deutet auf einen idealen Isolierungszeitpunkt 150 Tagen nach Immunisierung, zu diesem Zeitpunkt ist die IgG2 und IgG3 Reaktion aber noch relativ schwach, erst 300 Tage nach Immunisierung ist der Titer optimal für eine PBMC-Isolation.
Wir haben 3 neue Spezifitäten in unserem Sortiment!
Anti-Alpaka IgG (H+L)
| wdt_ID | Sekundärantikörper | Art.-Nr. |
|---|---|---|
| 1 | Ziege IgG anti-Alpaka IgG (H+L) ** | 128-005-003 |
| 2 | Ziege IgG anti-Alpaka IgG (H+L) [MinX Bo,Hu,Ms,Rb,Rt] ** | 128-005-160 |
Anti-Alpaka IgG2 + IgG3
Dieser Antikörper erkennt Alpaka und Lama IgG2- und IgG3-Subklassen in Serum und PBMCs, ohne Kreuzreaktion mit IgG1.
| wdt_ID | Sekundärantikörper | Art.-Nr. |
|---|---|---|
| 1 | Ziege IgG anti-Alpaka IgG2+IgG3 [MinX Bo,Hu,Ms,Rb,Rt] ** | 128-005-229 |
** Bitte beachten, diese Antikörper reagieren hauptsächlich mit der Fc Region. Sie sollten nicht für den Nachweis von VHH-Antikörpern eingesetzt werden. Hier finden Sie VHH-spezifische Antikörper und weitere Informationen.
Sekundärantikörper gegen Alpaka IgGs sind mit folgenden Konjugaten erhältlich:
• Unkonjugiert
• Horseradish Peroxidase
• Alkaline Phosphatase
• Biotin
• DyLight™ 405
• Alexa Fluor® 488
• Fluorescein (FITC)
• Cy™ 3
• R-Phycoerythrin
• Alexa Fluor® 594
• Rhodamine Red-X™
• Alexa Fluor® 647
• Cy™ 5
Literatur:
Für weitere Informationen über Antikörper aus Kameliden:
- Arbabi-Ghahroudi, M. (2017). Camelid Single-Domain Antibodies: Historical Perspective and Future Outlook. Front. Immunol. 8, 1-8.
- Daley, L.P., Gagliardo, L.F., Duffy, M.S., Smith, M.C., and Appleton, J.A. (2005). Application of Monoclonal Antibodies in Functional and Comparative Investigations of Heavy-Chain Immunoglobulins in New World Camelids. Clin. Diagn. Lab Immun. 12, 380-386.
- Maass, D.R., Sepulveda, J., Pernthaner, A., and Shoemaker, C.B. (2007). Alpaca (Lama pacos) as a convenient source of recombinant camelid heavy chain antibodies (VHHs). J. Immunol. 324, 13–25.
- Pardon, E., Laeremans, T., Triest, S., Rasmussen, S.G.F., Wohlkönig, A., Ruf, A., Muyldermans, S., Hol, W.G.J., Kobilka, B.K., and Steyaert, J. (2014). A general protocol for the generation of Nanobodies for structural biology. Nat. Protoc. 9, 674-693.
- Wagner, H.J., Sehrle, S. Weiss, E. Cavallari, M., and Weber, W. (2018). A Two-Step Approach for the Design and Generation of Nanobodies. Int. J. Mol. Sci. 19, 1-16.
AffiniPure™ Antibodies is trademark of Jackson ImmunoResearch Laboratories, Inc.
*Nanobody is a registered trademark of Ablynx N.V
DyLight™ fluorescent dyes is a trademark of Thermo Fisher Scientific.
Cy™ is a registered trademark of GE Healthcare.
Rhodamine Red™-X is a trademark of Invitrogen.
Alexa Fluor® is a trademark of Life Technologies Corp.
Images property Jackson ImmunoResearch Laboratories, Inc.
