dianova.com ist das Portal für Sekundärantikörper und Konjugate vom BIOZOL. In unserer Suche für Sekundärantikörper finden Sie mehr als 7000 Sekundärantikörper. Der Leitfaden in diesem Online Guide hilft Ihnen sich zu orientieren.
In unserer Antikörpersuche können Sie durch Auswahl von 6 Eigenschaften in Dropdownmenüs die jeweils benötigten Eigenschaften auswählen und kommen so schnell und unkompliziert zu den für Sie am besten geeigeten Produkten.
Sie haben weitere Fragen? Unser wissenschaftliches Beratungsteam hilft Ihnen gerne weiter.
Wir beraten Sie jederzeit gerne.

Inhalt
Für die optimale Auswahl von Sekundärantikörpern sind einige grundlegende Basisinformationen aus dem Bereich der Immunologie hilfreich. Diese finden Sie in den ersten beiden Abschnitten dieses Tutorials.
Antikörperaufbau
Eine kurze Einführung. Was Sie über die Struktur von Antikörpern wissen sollten.
Was sind Sekundärantikörper ?
Was ist ein Sekundärantikörper? Welche Vorteile hat der Einsatz von Sekundärantikörpern gegenüber anderen Nachweismethoden.
Schritt 1: Speziesreaktivität
Primärantikörper aus über 20 Spezies können mit unserer Auswahl an Sekundärantikörpern erkannt werden.
Schritt 2: Wirtsspezies
Neben Sekundärantikörpern aus Ziege und Esel stehen 9 andere Spezies zur Auswahl.
Schritt 3: Format
Das Format definiert welche Molekülform der Sekundärantikörper hat. Fab-Fragmente sind für spezielle Anwendungen optimiert
.
Schritt 4: Spezifität
Die Spezifität definiert welcher Teil des Primärantikörpers vom Sekundärantikörper erkannt wird.
Schritt 5: Konjugation (Label)
Die Auswahl des an den Sekundärantikörper gekoppelten Reportermoleküls ermöglicht den Einsatz in unterschiedlichen Methoden..
Schritt 6: Adsorption
Adsorption verhindert eine Kreuzreaktivität mit Primärantikörpern anderer Spezien und ist die Voraussetzung für erfolgreiche Mehrfachmarkierungen
Schritt 1: Speziesreaktivität
Gegen welche Spezies soll der Sekundärantikörper gerichtet sein?
Dies ist in der Regel die Spezies, aus der der Primärantikörper stammt. Nur in wenigen Ausnahmefällen ist es sinnvoll, kreuzreagierende Antikörper gegen eine verwandte Spezies einzusetzen.
Antikörper gegen Hamster IgG
Nahezu alle monoklonalen Antikörper aus Hamstern stammen von Maus-armenischen Hamster-Hybridomen. Die von diesen Hybridomen produzierten IgG sind also „armenische“ und nicht „syrische“ IgG. Die meisten kommerziell erhältlichen polyklonalen anti-Hamster IgG-Antikörper sind gegen syrische Hamster-IgG gerichtet und detektieren monoklonale Antikörper aus armenischem Hamster daher nicht so wirkungsvoll wie anti-armenische Hamster IgG.
Nachweis von Antikörpern aus Schaf, Ziege und Rind
Zwischen IgG´s aus Schaf, Ziege und Rindern besteht weitgehend Homologie, so dass gegen Ziege generierte Sekundärantikörper auch für die Detektion von Primärantikörpern aus dem Schaf/Rind verwendet werden können. Anti-Schaf-Antikörper eignen sich auch für den Nachweis von Primärantikörpern aus Ziege/Rind.
Schritt 2: Wirtsspezies
Aus welcher Wirtsspezies soll der Sekundärantikörper stammen?
Erfahrungsgemäß sind Antikörper aus der Ziege oder dem Esel für den Nachweis von Primärantikörpern der meisten Spezies geeignet.
Bei indirekten Mehrfachmarkierungen mit unkonjugierten Primärantikörpern sollten alle Sekundärantikörper-Konjugate
aus derselben Wirtsspezies stammen, damit Kreuzreaktionen der Sekundärantikörper untereinander vermieden werden. Stark präadsorbierte Antikörper (siehe auch Schritt Adsorbtion) aus dem Esel sind zwar spezifischer als die weniger adsorbierten Sekundärantikörper aus anderen Wirtsspezies, können aus diesem Grund aber auch weniger sensitiv sein.
Bei Mehrfachmarkierungen sollten alle Sekundärantikörper aus der gleichen Spezies stammen!
Bei Mehrfachmarkierungen sollte der
Sekundärantikörper gegen weitere Spezies, die zusätzlich nachgewiesen werden, adsorbiert sein (s. Schritt Adsorption)!
Um Hintergrund zu reduzieren, eignet sich zum Blockieren Normalserum aus der gleichen Spezies, aus der die Sekundärantikörper stammen, am besten!
Weitere Wirtsspezies:
Antikörper aus Rind zum Nachweis von Ziege Ig
Reagenzien, die im Labor verwendet werden, können in vielen Fällen Immunglobuline aus dem Rind enthalten. Dies gilt zum Beispiel für FCS in Zellkulturmedien, Milchpulver in Western Blot-Anwendungen oder BSA als Stabilisator für Proteine und Antikörper. Beim Nachweis von Primärantikörpern aus der Ziege kann das aufgrund der engen Verwandschaft von Ziege und Rind Probleme verursachen. Zum Nachweis von Ziege-Primärantikörpern ohne Kreuzreaktion mit Rind empfehlen wir Rind-anti-Ziege Antikörper von Jackson ImmunoResearch (805-xxx-180).
Antikörper aus dem Alpaka
Antikörper aus dem Alpaka eignen sich ebenfalls als Sekundärantikörper, wenn Reagenzien bovine IgGs enthalten. Zudem befinden sich im Serum von Kameliden neben dem konventionellen IgG1 (klassischer Aufbau), IgG2 und IgG3. Diese besitzen weder leichte Ketten noch CH1 Domänen in den schweren Ketten (s. Abschnitt Sekundärantikörperstruktur). Die Schwere-Ketten-Antikörper haben eine geringe Größe, sind äußerst stabil und zeigen eine hohe Spezifität und Affinität zum jeweiligen Antigen. Diese Eigenschaften machen sie für den Einsatz als Sekundärantikörper besonders geeignet.
Immunpräzipitation mit Kaninchen Antikörpern
Sollen Antigen-Antikörper-Komplexe von anderen Komponenten mittels Protein A-Agarose getrennt werden, werden vorzugsweise Kaninchen-Antikörper eingesetzt. Diese binden besser an Protein A als Antikörper aus Ziege oder anderen Spezies. IgG aus Ziege, Schaf und Esel (aber auch aus Kaninchen) binden gut an Protein G.
Schritt 3: Format
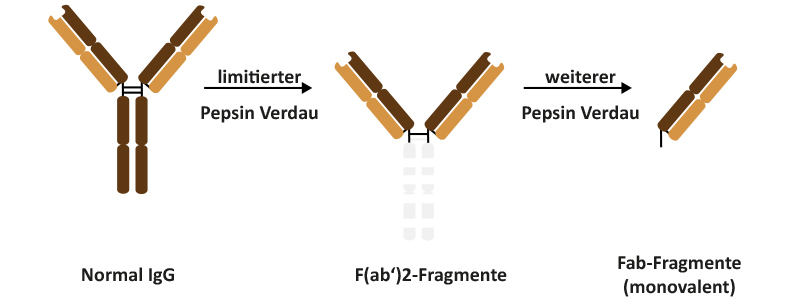

Proteolytische Vorbehandlung von Antikörpern mit Papain führt zur Spaltung in zwei monovalente Fab-Fragmente und ein Fc-Fragment. Die proteolytische Behandlung mit Pepsin ergibt ein verkürztes Fc-Fragment und ein bivalentes F(ab‘)2-Fragment.
Struktur des Sekundärantikörpers: Gesamtmolekül (H+L), F(ab‘)2- oder Fab-Fragment?
IgG-Gesamtmolekül
Das IgG-Gesamtmolekülist die am häufigsten verwendete Antikörperform und für die meisten Anwendungen am besten geeignet.
Durch Enzymatischen Verdau von IgG-Gesamtmolekülen (s. Abbildung) lassen sich Antikörper-Fragmente gewinnen, die über besondere Eigenschaften verfügen und sich deshalb in einigen Anwendungsbereichen besser als Nachweisreagenzien eignen als Gesamtmoleküle.
F(ab‘)2-Fragmente
F(ab‘)2-Fragmente werden verwendet, wenn verhindert werden soll, dass der Sekundärantikörper an Fc-Rezeptoren auf Zelloberflächen bindet, um eine dadurch mögliche Hintergrundfärbung zu vermeiden. Sie haben bessere Diffusionseigenschaften, da sie kleiner als Gesamtmoleküle sind und können nicht über den Fc-Teil aggregieren. Beide Eigenschaften können für spezielle Anwendungen von Vorteil sein.
Monovalente Fab-Fragmente
Monovalente Fab-Fragmente werden zur Blockierung und Doppelmarkierung von Primärantikörpern aus derselben Spezies oder als Blockierungsreagenzien gegen endogene Immunglobuline in Zell- und Gewebefärbungen eingesetzt, bei denen Gewebe und Primärantikörper aus derselben Spezies stammen. Da Fab-Fragmente nur eine antigenbindende Stelle haben (monovalent), können diese, nachdem sie ihr Zielmolekül gebunden haben, keine weiteren Antikörper binden.
Der Einsatz von F(ab‘)2-Fragmenten verhindert nicht das Binden des Primärantikörpers an Fc-Rezeptoren! Das Blocken mit Normalserum, das aus derselben Wirtsspezies wie der Sekundärantikörper stammt, ist in diesem Fall nicht immer erfolgreich. Bei durch Fc-Rezeptoren verursachtem Hintergrund können Sie mit IgG oder IgG-Fragmenten der Spezies, aus der das untersuchte Material stammt, blockieren und mit einem gegen diese Spezies präadsorbierten Sekundärantikörper arbeiten.
Schritt 4: Spezifiät
Was soll der Sekundärantikörper erkennen?
Für immunologische Assays werden größtenteils polyklonale Antikörper vom Typ IgG (z. B. aus Kaninchen, Ziege, Huhn etc.) oder monoklonale Antikörper aus Maus, Ratte oder auch Hamster, die aus B-cell Hybridomen gewonnen werden, eingesetzt. Sekundärantikörper sollen dabei eine möglichst hohe Sensitivität für diesen Primärantikörper haben.
In der Regel ist dies ein Sekundärantikörper, für dessen Gewinnung als Immunogen ein Gesamtmolekül IgG(H+L) eingesetzt wurde. Dieser erkennt eine Vielzahl von Epitopen auf Antikörpern verschiedener Klassen und Subklassen. (s. Abbildung Antikörperaufbau)
Soll in einem geplanten Assay nur ein Primärantikörper erkannt werden und sind Immunglobuline anderer Klassen oder Subklassen kein Störfaktor, wie dies in den meisten Anwendungen der Fall ist, ist die Spezifität IgG (H+L) normalerweise am besten geeignet.
Häufig sollen in einem Experiment mehrere Primärantikörper aus unterschiedlichen Spezies gleichzeitig nachgewiesen werden (Mehrfachmarkierungen). In diesem Fall muss eine kreuzweise Erkennung verhindert werden. Dies geschieht über die Adsorption von Antikörpern. Die optimale Spezifität für jeden der Sekundärantikörper ist dann immer noch IgG(H+L).
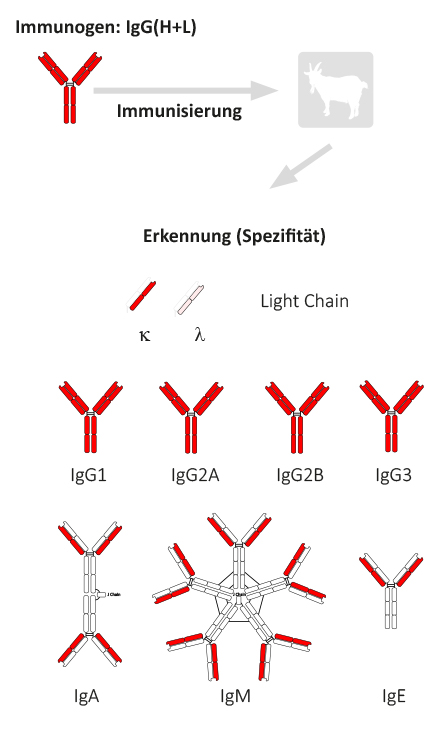

Beispiel der Herstellung eines Antikörpers der Spezifität IgG (H+L) der Maus
Die Tierspezies (z.B. Ziege), in der das Antiserum gewonnen werden soll („Wirt“), wird mit aufgereinigtem Immunglobulin oder Immunglobulinteilen der entsprechenden Zielspezies immunisiert. In der Regel werden die Immunglobuline, die zur Immunisierung verwendet werden, aus Gesamtserum gewonnen, dh. die Zusammensetzung der einzelnen Subklassen und Teile entspricht der Normalverteilung im Serum der Spezies.
Antiserum von mit IgG(H+L) immunisierten Tieren enthält Antikörper, die sowohl gegen die leichte als auch gegen die schwere Kette des IgG-Moleküls gerichtet sind. Dieses Antiserum reagiert sowohl mit den F(ab‘)2-Anteilen als auch mit dem Fc-Anteil des IgG. Anti-IgG reagiert deshalb auch sehr gut mit anderen Immunglobulinklassen (IgM, IgA, IgE), da diese dieselben leichten Ketten (κ und λ) haben. Anti-IgG (H+L) Antikörper, die nicht präadsorbiert sind (siehe Schritt 6), besitzen ca. 40% – 60% Reaktivität mit leichten Ketten. Bei hoch adsorbierten anti-IgG (H+L) Antikörpern kann diese wesentlich geringer ausfallen. So bindet z.B. Katalog-Nr. 705-XXX-147 nur zu 9% – 30% an leichte Ketten.
Welche Sonderfälle gibt es für die Auswahl der Spezifität?
Hier finden Sie einige Beispiele zu Sonderfällen. Diese Beispiele decken aber nur einen kleinen Bereich der bei uns verfügbaren Spezifitäten und häufigeren Anwendungen ab. Mit mehr als 70 Auswahlmöglichkeiten im Bereich Spezifität / Erkennung bietet Ihnen unsere Online Suche viele weitere Möglichkeiten.
Klassenspezifischer Antikörpernachweis
Nachweis von klassenspezifischen Antikörpern bei gleichzeitiger störender Anwesenheit von Antikörpern anderer Klassen oder gleichzeitiger Nachweis von Antikörperklassen.


anti-IgG-Fc-Fragment
Die Immunisierung (z.B. der Ziege) mit aufgereinigtem IgG Fc-Fragment (z.B. aus Maus/Mensch) führt zu Antikörpern, die hochspezifisch die schwere Kette des IgG-Moleküls detektieren. Da die Unterschiede der verschiedenen Immunglobulinklassen im Bereich der schweren Kette liegen, lassen sich hier sehr gut IgG, nicht aber IgM, IgA und IgE nachweisen. Diese Fc-Fragment-spezifischen Antikörper werden zusätzlich gegen F(ab‘)2-Fragmente präadsorbiert. In einigen Fällen wird zudem eine mögliche Kreuzreaktion gegen IgM und IgA (anti-Human) oder nur gegen IgM (anti-Maus, anti-Ratte) durch weitere Präadsorption(en) minimiert. Diese Antikörper (anti-Human, anti-Maus, anti-Ratte) sind durch „Fcγ“ gekennzeichnet. Sie weisen weniger als 1% Restaktivität gegen leichte Ketten oder IgM bzw. IgA auf.


anti-IgM (µ-Kette), anti-IgM Fc5µ
Zur Herstellung von IgM-spezifischen Antikörpern wird die Wirtsspezies (z.B. Ziege) mit aufgereinigtem IgM (Maus und Ratte) oder Trypsin-verdautem, gereinigten IgM Fc5µ (Human) immunisiert. Nach affinitätschromatographischer Reinigung werden die anti-Maus und anti-Ratte IgM (µ-Kette)-spezifischen Antikörper gegen IgG adsorbiert. Die anti-Human IgM Fc5µ werden gegen IgG und IgA adsorbiert. Die anti-IgM-spezifischen Antikörper weisen in der Regel weniger als 1% Restaktivität gegen IgG oder leichte Ketten auf.




anti-IgA (a-Kette) / anti-IgE (e-Kette)
Antikörper reagieren mit der schweren Kette von IgA oder IgE und sind gegen andere Subklassen adsorbiert, so dass keine nennenswerten Kreuzreaktionen mit anderen Klasssen wie IgG oder IgM auftreten.
Nachweis von Subklassen
Nachweis von monoklonalen Antikörpern bestimmter Subklassen.
Gleichzeitiger Nachweis von monoklonalen Antikörpern unterschiedlicher Subklassen aus der gleichen Spezies.


Subklassenspezifische anti-Maus Antikörper gegen IgG1, IgG2a, IgG2b, IgG2c und IgG3
Diese Antikörper sollten aufgrund ihrer hohen Spezifität nur eingesetzt werden, wenn eine Unterscheidung von Maus-Subklassen erforderlich ist.
Für einen Nachweis der Maus IgG-Subklassen mit annähernd gleicher Sensitivität empfehlen wir den Ziege anti-Maus IgG (Subklassen 1, 2a, 2b und 3) Fcγ-Fragment-spezifischen Antikörper (Katalog-Nr. 115-XXX-164), der eine ausgeglichenere Reaktivität gegenüber diesen Subklassen besitzt.
Gleichmäßige Erkennung von Subklassen



Da das jeweilige Antiserum (z.B. aus der Ziege) überwiegend gegen leichte Ketten des κ-Typs gerichtet ist, ist die Sensitivität von anti-F(ab‘)2-Fragment Antikörpern bei der Erkennung von Primärantikörpern, die leichte Ketten vom λ-Typ tragen, eingeschränkt.
anti-IgG F(ab‘)2-Fragment
Diese Antikörper werden durch Immunisierung mit aufgereinigtem F(ab‘)2-Fragment des Gesamt-IgG gewonnen. Da der Anteil an schwerer Kette des F(ab‘)2-Fragments nur sehr schwach immunogen wirkt, erhält man auf diese Weise Antikörper, die, abhängig vom Grad ihrer Präadsorption (siehe Schritt 6), zu mehr als 60% gegen die leichte Kette gerichtet sind. Anti-F(ab‘)2-Fragment Antikörper werden zusätzlich gegen IgG Fc-Fragment präadsorbiert und reagieren deshalb nur mit dem Fab-Teil des IgG.
Mit diesen Immunreagenzien lassen sich alle lg-Klassen und Subklassen (IgM, IgG1-4, IgA, etc.) relativ gleichmäßig nachweisen. Diese Antikörper sind also optimal geeignet, wenn alle Ig-Klassen unabhängig von der Subklasse nachgewiesen werden sollen oder wenn nicht sicher ist, welcher Klasse der Primärantikörper angehört.




anti-IgG + IgM (H+L) / anti-IgG + IgM + IgA (H+L)
Um eine gleichmäßige Reaktivität zu erreichen, werden diese Produkte durch Mischen verschiedender Antikörper gegen die einzelnen Klassen hergestellt. In einer Mischung von anti-IgG + IgM (H+L) variiert die Reaktivität mit leichten Ketten von 30% bis 45%. Die anti-IgM-Gesamtreaktivität (einschließlich gegen leichte Ketten) in der Mischung liegt ca. zwischen 55% – 70%.
Nachweis von leichten Ketten

Anti-IgG leichte Kette-spezifische Antikörper reagieren mit nativen Primärantikörpern, die zur Detektion von Proteinen in Western Blots eingesetzt werden.
Bei geeigneter Verdünnung reagieren sie im Blot nicht mit der reduzierten und denaturierten schweren Kette (50 kDa) des IgG-Moleküls, zum Beispiel bei Proben die aus Immunpräzipitationsversuchen (IP) stammen, bei denen große Mengen der denaturierten schweren Kette das Zielprotein überdecken können.
Anti-Light Chain Antikörper haben eine starke Reaktivität mit nativen leichten IgG-Ketten, die Sensitivität bei reduzierten/denaturierten Formen kann aber veringert sein. Für eine sensitive / quantitative Detektion von leichten IgG-Ketten im Western Blot sind sie nicht geeignet.
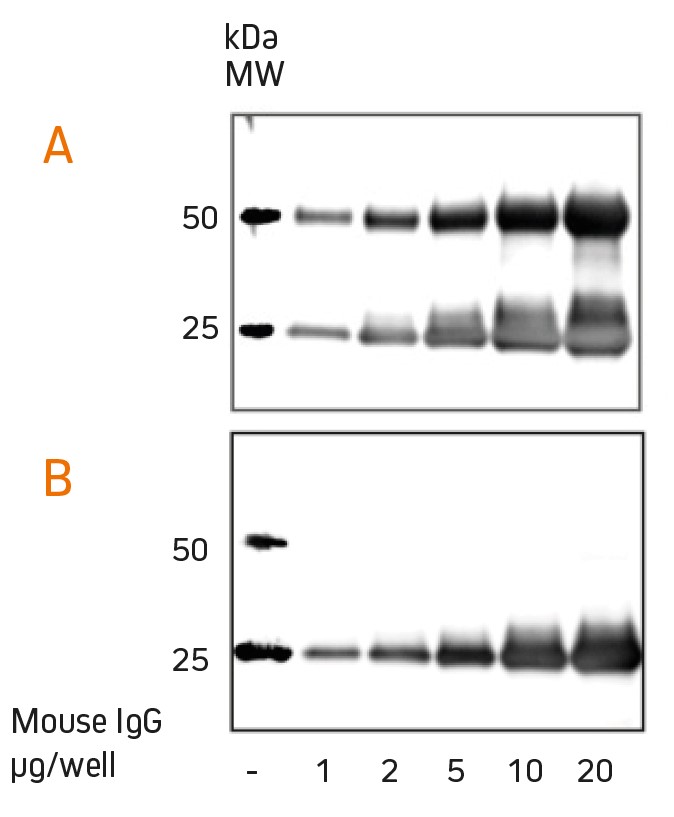

Nachweis von Maus IgG mit Anti-Maus IgG(H+L) (115-035-003) (A) und Anti-Maus Light-Chain-spezifischem Antikörper (115-035-174) (B). Der Leichte Kette Antikörper ermöglicht den Nachweis von Zielproteinen bei 50 kDa, die sonst überdeckt sind (Abb. Jackson ImmunoResearch)
Schritt 5: Konjugation (Label)
Welche Konjugation soll der Sekundärantikörper haben?
Die Wahl der Konjugate hängt von der eingesetzten Methode und der gewünschten Art der Detektion ab (enzymatisch, verstärkt, direkt, etc.). Insbesondere bei den Fluoreszenzfarbstoffen ist darauf zu achten, dass die notwendigen Anregungsquellen und Filter zur Verfügung stehen. Für fluoreszenzbasierte Methoden in der Immunhisto- und Zytochemie empfehlen wir Ihnen generell photostabile Farbstoffe wie Carbocyanine (z.B. Cy2, Cy3, Cy5) oder AlexaFluor® traditionellen Farbstoffen (z. B. FITC, TRITC) vorzuziehen. Einige der Farbstoffe sind auch für die Superresolution Mikroskopie geeignet. Für STED eignen sich die Farbstoffe Alexa Fluor 488, FITC und Alexa Fluor 594, für STORM eignen sich die Farbstoffe Alexa Fluor 488, FITC, Cy3, Alexa Fluor 647, Cy5 und Alexa Fluor 790.
Sekundärantikörperverdünnungen
Reporter / Label für verschiedene Anwendungen und empfohlene Verdünnungen
Fluorophore
Nebenstehend finden Sie Links zu Resourcen über unterschiedliche Fluorophore
Enzymkonjugate
Nebenstehend finden Sie Links zu Resourcen über unterschiedliche Enzymkonjugaten
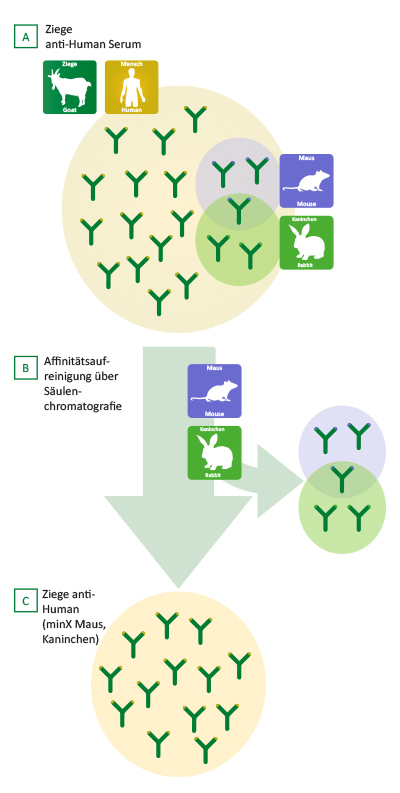
Schritt 6: Adsorption
Welcher Grad der (Prä)-Adsorption ist für meinen Sekundärantikörper erforderlich?
Prinzipiell können Ig-spezifische Antikörper gegen eine bestimmte Spezies mit Immunglobulinen und Serumproteinen anderer Spezies mehr oder weniger stark kreuzreagieren. Deshalb werden Antikörper teilweise gegen Immunglobuline und Serumproteine einer oder mehrerer Fremdspezies präadsorbiert, wodurch eine Kreuzreaktivität mit Molekülen dieser Spezies weitgehend beseitigt wird (Kreuzreaktivität < 1%). Diese haben dann eine „minimierte Kreuzreaktivität“ (minimal cross-reaction to (MinX)) bzw. werden als adsorbiert gegen … bezeichnet.
Adsorbierte Antikörper werden empfohlen, wenn die mögliche Anwesenheit von Immunglobulinen einer anderen Spezies im Versuchsansatz zu Kreuzreaktionen führen kann.
Falls Antikörper mit unterschiedlichen Präadsorptionen zur Auswahl stehen, sollte berücksichtigt werden, dass Antikörper, die gegen nahe verwandte Spezies adsorbiert wurden, z.T. eine stark reduzierte Epitoperkennung aufweisen und deshalb einige monoklonale Antikörper nur noch schwach erkennen. Dies gilt insbesondere für anti-Maus IgG (adsorbiert gegen Ratte), anti-Ratte IgG (adsorbiert gegen Maus) oder anti-(arm.)Hamster IgG (adsorbiert gegen Maus, Ratte).
Gegen eng verwandte Spezies präadsorbierte Antikörper reagieren möglicherweise mit einigen IgG-Subklassen (v. a. IgG2b, IgG2c und IgG3) nicht gut. Dies gilt besonders für die Subklassen, die weitestgehend homolog mit der Spezies sind, gegen die präadsorbiert wurde. So sollte beispielsweise anti-Maus IgG, das gegen Ratten-IgG präadsorbiert wurde, nur eingesetzt werden, wenn ein Primärantikörper aus der Maus a) in Rattengewebe, welches Ratten-Immunglobuline enthält, oder b) in anderen Geweben zusätzlich zu einem Primärantikörper aus der Ratte nachgewiesen werden soll.
Rinderserumalbumin (BSA) und Trockenmilch aus Rind enthalten meist Verunreinigungen boviner Immunglobuline, welche mit anti-Rind, anti-Ziege, anti-Pferd und anti-Schaf IgG Antikörpern reagieren. Daher kann die Verwendung von BSA und/oder Trockenmilch zur Blockierung oder Verdünnung dieser Sekundärantikörper die Hintergrundfärbung signifikant erhöhen oder den Antikörpertiter reduzieren. Um dieses Problem zu umgehen, empfiehlt sich die Verwendung von speziell IgG-freiem BSA von Jackson ImmunoResearch (z.B. Katalog-Nr. 001-000-161). Um eine Kreuzreaktivität mit Milchpulver, BSA oder FCS zu verhindern, empfehlen wir zum Nachweis von Ziege-Primärantikörpern Sekundärantikörper aus dem Rind (805-xxx-180).

In 6 Schritten zum richtigen Sekundärantikörper
Den Online Guide gibt es auch als PDF in unserer beliebten Broschüre “6 Schritte zum richtigen Sekundärantikörper” zum Download. Dort erhalten Sie alle Informationen, die Sie benötigen kompakt zusammengefasst, um den besten Antikörper für Ihre Anwendung zu finden .















