Die Auswahl von Sekundärantikörpern zur simultanen Detektion von mehr als einem Antigen hängt von wenigstens zwei wichtigen Kriterien ab:
A) Verfügbarkeit von Sekundärantikörpern, die
1. von derselben Wirtsspezies stammen, so dass sie einander nicht erkennen,
2. keine anderen Primärantikörper im Versuchssystem erkennen,
3. keine Immunglobuline anderer Spezies erkennen, die möglicherweise im Versuchssystem präsent sind, und
4. nicht mit dem untersuchten Gewebe oder Zellmaterial kreuzreagieren
B) Verwendung von Labeln (Fluorochrome, Enzym-Reaktionsprodukte, elektronendichte Partikel), die optisch gut aufgelöst werden können.
Die mit MinX (Minimal Cross-Reactivity/Reaction) gekennzeichneten, affinitätsgereinigten Antikörper werden speziell hergestellt, um diese Kriterien zu erfüllen. Sie wurden mittels ELISA als nicht kreuzreaktiv getestet und sind gegen IgG und/oder Serumproteine anderer Spezies adsorbiert.
Ihre Kreuzreaktivität (X) mit Immunglobulinen dieser angegebenen Spezies ist „minimal“ (Min), d. h. unterhalb 1%.
(Ha = Armenischer Hamster, Hs = Syrischer Hamster, Ck = Huhn, Hu = Human, Rb = Kaninchen, Ms = Maus, Gp = Meerschweinchen, Ho = Pferd, Rt = Ratte, Bo = Rind, Sh = Schaf, Sw = Schwein, Go = Ziege)
Das folgende Schema zeigt ein Beispiel für den Einsatz solcher Kreuzreaktions-minimierten Antikörper in einer Mehrfachmarkierung. Die in Schritt 3 verwendeten Sekundärantikörper erkennen sich gegenseitig nicht, da sie alle aus Esel stammen. Durch die Festphasen-Präadsorption gegen Serumproteine der Primärantikörper-Spezies erkennen sie auch nicht die anderen Primärantikörper aus Schritt 2. Ebenso reagieren sie nicht mit den möglicherweise im Rattengewebe vorhandenen Ratte-Immunglobulinen und Serumproteinen. Jedoch geht die durch Ig/ Serumprotein-Adsorptionen gewonnene Erhöhung der Spezifität auf Kosten der Sensitivität: Esel-Sekundärantikörper, die gegen Serumproteine von bis zu zehn verschiedenen Spezies adsorbiert wurden, sind weniger affin als Ziege-Sekundärantikörper, die gegen Ig/ Serumproteine von drei bis fünf verschiedenen Spezies adsorbiert worden sind.
Hinweis: Antikörper, die gegen eine nahe verwandte Spezies adsorbiert wurden, weisen z. T. eine reduzierte Epitoperkennung auf und können monoklonale Antikörper mit seltenen IgG-Subklassen (IgG2b, IgG3), die weitestgehend homolog mit der Spezies sind, gegen die präadsorbiert wurde, nur eingeschränkt erkennen.
Dreifachmarkierung von Rattengewebe
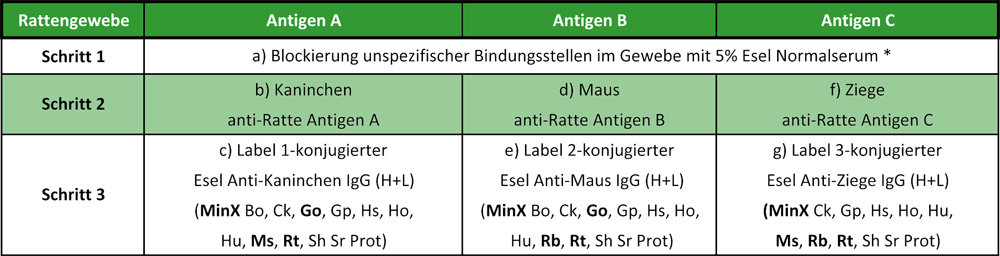
* Siehe auch: Beispiel Fab-Blocking von Gewebe
Hinweis: Der Nachweis von Antigen A, B und C kann parallel oder sukzessiv erfolgen. Im Parallelansatz werden die Antikörper in Schritt 2 (b, d, f) und 3 (c, e, g) in einem Cocktail aufgetragen, im Sukzessivansatz wird von a) bis g) jeweils in Einzelschritten nacheinander inkubiert. In beiden Vorgehensweisen wird zwischen den Antikörper-Inkubationen und nach der Blockierung (a) jeweils gründlich gewaschen. Bei starkem Hintergrund kann im Sukzessivansatz eine wiederholte Blockierung vor Schritt d) und f) erforderlich sein. Die Mehrfachmarkierung kann im Parallelverfahren durchgeführt werden, wenn das Färbe- und Hintergrundverhalten der Antikörper sich durch Mischung im Vergleich zu Einzelmarkierungen (Sukzessivfärbungen) nicht verändert. In Mischung können Antikörper (Immunglobuline) aufgrund spezifischer oder unspezifischer Wechselwirkungen miteinander reagieren und den Antigennachweis erschweren. Aus diesem Grund sollte dem Antikörperverdünnungspuffer außerdem kein Normalserum zugesetzt werden.
Weitere Tipps und Tricks:
Eine gute Übersicht über das Mehrfarben-Immunfluoreszenz-Labeling in der konfokalen Mikroskopie gibt der Beitrag von Brelje, Wessendorf und Sorenson, “Multi-color laser scanning confocal immunofluorescence microscopy: Practical application and limitations.” In Cell Biological Applications of Confocal Microscopy, B. Matsumoto. Orlando, FL: Academic Press, Inc. (Methods Cell. Biol. 1993, Vol. 38, 97; Methods Cell. Biol. 2002, Vol. 70, 165).
Beispielprotokoll: Vierfach-Immunfluoreszenzmarkierung im Parallelansatz
Vierfachmarkierung der Kalzium-bindenden Proteine Calbindin, Parvalbumin und Calretinin sowie perineuronaler Netze
(nach: Härtig et al. 1996, J. Neurosci. Methods 67: 89-95 und Schwaller et al. 1999, J. Neurosci. Methods 92: 137-144)
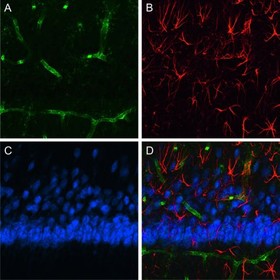
Hippocampus der Ratte: A) Biotinyliertes Solanum tuberosum Agglutinin/Alexa Fluor 488-Streptavidin (Gefäße), B) Kaninchen-anti-GFAP/Cy3-Esel-anti-Kaninchen (Astroglia), C) Maus-anti-NeuN/AlexaFluor 647-Esel-anti-Maus (MinX Ratten IgG; neuronale Kerne), D) “Merge” (W. Härtig, Paul Flechsig Institute for Brain Research, University of Leipzig, Germany)
Die Cytochemie Kalzium-bindender Proteine ist oft eine Methode der Wahl zur Darstellung morphologischer Details immunpositiver Nervenzellen. Eine Mehrfachmarkierung dieser Marker tragen zur Aufklärung von komplizierten Struktur-Funktions-Beziehungen im Zentralnervensystem bei.
Material: 30 µm-dicke, frei bewegliche Gefrierschnitte von Paraformaldehyd-fixiertem Rattenhirn.*
Hinweis: Die Schnitte werden frei flottierend in Vertiefungen von Mehr-Well-Platten gefärbt/gewaschen und erst nach der Färbung auf Objektträger aufgezogen. Das Transferieren der Schnitte in einzelne Wells erfolgt mit Hilfe eines geeigneten Pinsels.
Alle Schritte bei Raumtemperatur durchführen:
1. 3 x 10 min Waschen des Gewebes mit 0,1 M Tris-gepufferter Kochsalzlösung (TBS), pH 7,4
2. Blocken unspezifischer Bindungsstellen des Gewebes mit 5% Esel-Normalserum (Kat.-Nr. 017-000-121) in TBS + 0,3% Triton X-100 (= ENS-TBS-T); 1 h
3. Inkubation mit einem Cocktail primärer Antikörper und Wisteria floribunda Agglutinin in ENS-TBS-T; 16 h* bei Raumtemperatur:
• Maus-anti-Calbindin [1:200; Klon CL-300; Sigma]
• Kaninchen-anti-Parvalbumin [1:500; Swant]
• Ziege-anti-Calretinin [1:100; Swant]
• Biotinyliertes, reduziertes Wisteria floribunda Agglutinin (20 µg/ml; Sigma)
4. 3 x 10 min Waschen der Schnitte mit TBS
5. Inkubation mit einem Cocktail sekundärer fluorochromierter Antikörper, verdünnt mit TBS (+ 2% Rinderserumalbumin, z.B. Fraktion V)]; 1 h:
• Alexa Fluor 488-Esel-anti-Maus IgG (Kat.-Nr.: 715-545-151; 20 µg/ml)
• Cy3-Esel-anti-Kaninchen IgG (711-165-152; 20 µg/ml)
• AMCA-Esel-anti-Ziege IgG (705-155-147; 30 µg/ml)
• Alexa Fluor 647-Streptavidin (016-600-084; 20 µg/ml)
6. 3 x 10 min Waschen der Schnitte mit TBS und mit destilliertem Wasser (1 min)
7. Aufziehen der Schnitte auf fluoreszenzfreie Objektträger; Lufttrocknung
8. Eindecken z.B. mit Entellan (in Toluen; Merck) oder mit einem wässrigen Eindeckmedium.
* Bitte beachten Sie: Dies ist kein Standardprotokoll. Die Inkubationszeit für die Primärantikörper ist abhängig von den Antikörpereigenschaften und der Dicke der Gewebeschnitte. Sie kann von 1 h bis mehreren Stunden bei Raumtemperatur bis zu einigen Tagen bei 4°C variieren.
Immunfluoreszenznachweis-Methoden lassen sich auch an Paraffin- und Kryostatschnitten sowie an Wholemounts durchführen, vorausgesetzt es stehen geeignete Primärantikörper zur Verfügung. Zur empfindlichen Darstellung bestimmter, oft Membran-assoziierter Antigene behandelt man die Gewebe während der histochemischen Verfahren mit Detergenzien (häufig verwendet: 0,1-1% Triton X-100, das oft der Blockierlösung für die Primärantikörper zugefügt wird). Weil Triton irreversibel wirkt, reicht sein einmaliger Einsatz während der Versuche und es kann auf seinen Zusatz zu Sekundärantikörpern verzichtet werden. Durch höhere Tritonanteile in Inkubationslösungen, die für verschiedenene immunhistochemische Verfahren eingesetzt werden, können Artefakte wie z.B. Myelinfärbungen auftreten (siehe Weruaga et al. 1998).
