Was ist IgY
Immunglobulin Y (IgY) wurden bereits Ende des 19. Jahrhunderts in Hühnereiern nachgewiesen. Felix Klemperer zeigte, dass die Immunität immunisierter Hühner nicht nur auf das Serum, sondern auch auf das Eigelb übertragen wird. Für lange Zeit wurden diese Moleküle jedoch mit IgG verwechselt und erst Mitte des 20. Jahrhunderts als eine eigenständige Immunglobulinklasse charakterisiert.
Eigenschaften
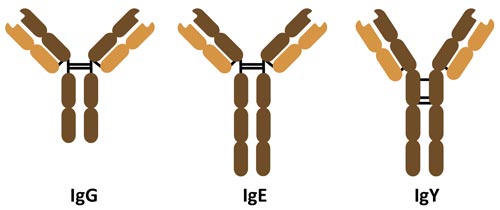
Hühnerantikörper (IgY) haben eine vergleichbare Funktion zum IgG aus Mammalia, wohingegen die Struktur eher dem IgE gleicht (siehe Abbildung). Wie IgG, verfügt IgY über zwei Antigenbindungsstellen und hat die gleiche charakteristische Y-Struktur, bestehend aus zwei leichten- und zwei schweren Ketten. Mit einer weiteren konstanten Domäne in der schweren Kette, ist das Molekulargewicht von IgY-Immunglobulinen allerdings höher (~180 kDa). Durch eine weniger flexible hinge-Region, ist die Beweglichkeit von IgY eingeschränkt. Es wird vermutet, dass die CH2 Domäne in den schweren Ketten der aviären Antikörper, ein evolutionärer Vorläufer zur hinge-Region der Mammalia-IgG sein könnte.
Vorteile
IgY können tierschonend in großer Menge produziert werden. Eine einzelne Henne kann bis zu sieben Eier pro Woche legen, aus jedem Ei können anschließend 50-100mg IgY-Antikörper isoliert werden. Da Hühner nicht zu den Mammalia gehören, lassen sich hier Antikörper mit hoher Avidität gegenüber hochkonservierten Säuger-Proteinen gewinnen, die in Kaninchen oft keine Immunantwort auslösen. Durch die phylogenetische Distanz zwischen IgG und IgY ergeben sich weitere Vorteile. IgY-Immunglobuline binden keine Fc-Rezeptoren auf Säugerzellen oder Fc-bindende Proteine aus Bakterien wie Protein A (Staphylococcus aureus), Protein G (Streptococcus sp.) oder Protein L (Peptostreptococcus magnus). Dadurch verringert sich die Gefahr einer unspezifischen Hintergrundfärbung und falsch-positiven Ergebnissen, wie es in der Durchflusszytometrie (FACS) der Fall sein kann. Zudem reagiert IgY nicht mit humanen Rheumafaktoren (RF), welche in Serumproben von Patienten mit rheumatoider Arthritis, aber auch zu einem geringen Teil (3-5%) in gesunden Menschen zu finden sind. IgY-Antikörper aktiveren zudem keine Komplementkaskade in Mammalia und reagieren nicht mit humanen anti-Mausantikörpern (HAMA).
Topseller
Mit unseren Partner Nordic MUbio können wir Ihnen ab jetzt Antikörper von Gallus Immunotech Inc. anbieten. Gallus war eine der ersten Hersteller, der sich auf die Produktion von Immunglobulinen aus Hühnereiern spezialisiert hat und führend auf diesem Gebiet ist.
Hier finden Sie eine Auswahl unserer aktuellen Topseller:
- Anti-c-myc Epitop-Tag (alle,rek) aus Huhn – unkonj.
- Anti-c-myc Epitop-Tag (alle,rek) aus Huhn – Biotin
- Anti-Neurotoxin Type A (Heavy Chain Binding Domain) (Ba) aus Huhn – unkonj.
- Weitere Primärantikörper aus Hühnereiern
Literatur
- Klemperer, F. Ueber natürliche Immunität und ihre Verwerthung für die Immunisirungstherapie. Archiv f. experiment. Pathol. u. Pharmakol 31, 356–382 (1893).
- Leslie, G. A. & Clem, L. W. PHYLOGENY OF IMMUNOGLOBULIN STRUCTURE AND FUNCTION. J Exp Med 130, 1337–1352 (1969).
- Putnam, F. W., Takahashi, N., Tetaert, D., Debuire, B. & Lin, L. C. Amino acid sequence of the first constant region domain and the hinge region of the delta heavy chain of human IgD. PNAS 78, 6168–6172 (1981).
- Larsson, A., Bålöw, R. M., Lindahl, T. L. & Forsberg, P. O. Chicken antibodies: taking advantage of evolution – a review. Poult. Sci. 72, 1807–1812 (1993).
- Warr, G. W., Magor, K. E. & Higgins, D. A. IgY: clues to the origins of modern antibodies. Immunology Today 16, 392–398 (1995).
- Carlander, D. Avian IgY antibody : In vitro and in vivo. Acta Universitatis Upsaliensis. Comprehensive Summaries of Uppsala Dissertations from the Faculty of Medicine 1119. 53 pp. (2002).
- Niederstadt, L. & Schade, R. Was sind und was können polyklonale aviäre Antikörper. BIOspektrum 18, 174-177 (2012)
- Munhoz, L. S. et al. Avian IgY antibodies: characteristics and applications in immunodiagnostic. Ciência Rural 44, 153–160 (2014).