Eine wichtige Voraussetzung für indirekte Mehrfachmarkierungen von verschiedenen Biomolekülen im gleichen Gewebe sind selektive primäre Detektionsreagenzien, die von sekundären Immunkonjugaten gleichzeitig und ohne Kreuzreaktionen dargestellt werden können. Dies wird durch Strukturunterschiede der primären Detektionsreagenzien möglich: Primärantikörper, die aus unterschiedlichen Wirtsspezies stammen oder anderen Isotypen angehören, lassen sich durch Spezies- oder Isotyp-spezifische Sekundärantikörper-Konjugate differenziert nachweisen.
Manchmal stehen unterscheidbare Primärantikörper jedoch nicht zur Verfügung oder fehlende Strukturunterschiede, zum Beispiel von Nukleinsäure-Sequenzen, erlauben keine differenzierte Erkennung durch Sekundärantikörper. In diesen Fällen kann man auf sogenannte Hapten-anti-Hapten-Techniken zurückgreifen.
Als Haptene bezeichnet man sehr kleine Moleküle mit definierter chemischer Struktur, die ohne Kopplung an ein Trägerprotein aufgrund ihrer Größe nicht immunogen sind. Sie können aber als eine antigene Determinante durch anti-Hapten-Antikörpern erkannt werden. Bekannte Haptene sind zum Beispiel Biotin oder Digoxigenin, aber auch das Fluorochrom Fluorescein. Über ihre chemisch aktivierten Derivate (z.B. Fluoresceinisothiocyanat [FITC] oder Aktivester) können Haptene kovalent an Nucleotide, Antikörper, Enzyme oder andere Biomoleküle gekoppelt werden. Letztere behalten ihre Spezifität auch nach Konjugation mit Haptenen und können so verändert durch Hapten-spezifische Antikörper mit deutlich getrennten Signalen dargestellt werden.
Das primäre Detektionsreagenz wird dadurch nicht nur spezifisch nachgewiesen, sondern oft auch in seinem Signal verstärkt. Ein weiterer wesentlicher Vorteil von Hapten-anti-Hapten-Nachweismethoden ist, dass sie hintergrundarmes Färben von relevanten Antigenen erlauben, da Hapten-ähnliche Strukturen mit Ausnahme von Biotin in tierischen Zellen und Geweben nicht auftreten.
Antikörper für Hapten-anti-Hapten-Techniken
Wichtigste Anwendungen von Antikörpern gegen Haptene:
- Fluoreszenz in situ Hybridisierung (FISH) für unterschiedliche Markierungen mehrerer Sonden
- In situ Hybridisierungsexperimente auf der Grundlage simultan eingesetzter Fluorescein- und Digoxigenin-markierter Oligonukleotide.
- Nachweis und Signalverstärkung von haptenylierten Primärantikörpern.
- Mehrfachmarkierungen von Hapten-konjugierten Primärantikörpern auch aus der gleichen Wirtsspezies.
Mit anti-Fluorescein-, anti-Digoxin- und anti-Biotin-Konjugaten von Jackson ImmunoResearch Inc. stehen sensitive Antikörper gegen unterschiedliche Haptene für den Einsatz in einem breiten Spektrum von Methoden zur Verfügung stehen. Anti-Hapten Konjugate finden unter anderem als Nachweisreagenzien in DNA-Hybridisierungstechniken, der Immunhistochemie, der Durchflusszytometrie, in ELISA-Anwendungen oder dem Nachweis haptenylierter Proben auf Blot-Membranen Verwendung. Die hohe Spezifität macht Sie zu idealen Reagenzien in Anwendungen, wo die Signaldetektion durch erheblichen Hintergrund (z.B. durch endogenes Biotin) erschwert ist, in Mehrfachmarkierungen, wo eine eindeutige Differenzierung der relevanten Biomoleküle gewährleistet sein muß sowie in Verfahren, in denen das Signal nach verschiedenen Schemen verstärkt werden soll. Dafür sind eine große Auswahl von Fluoreszenz-, Enzym- und Biotin-Konjugaten monoklonaler Maus-Antikörper gegen Fluorescein, Digoxin (erkennt Digoxigenin) und Biotin erhältlich.
Anti-Hapten-Konjugate zur Markierung haptenylierter Primärantikörper in Zell- und Gewebe-Färbungen
Eine wesentliche Sensitivitätssteigerung erfahren histochemische Nachweise von FISH-Sonden und Primärantikörpern durch die als CARD (Catalyzed Reporter Deposition)-Methode oder auch TSA (Tyramide Signal Amplification)-Technologie bezeichnete Amplifikation. Bei diesen Verfahren katalysieren Peroxidase-markierte Antikörper gegen Haptene die Akkumulation zahlreicher fluorochromierter Tyramid-Derivate an den nachzuweisenden Antigenen, wobei starke Fluoreszenz-Signale generiert werden.
Anti-Hapten Konjugate in der Fluoreszenz in situ Hybridisierung (FISH)
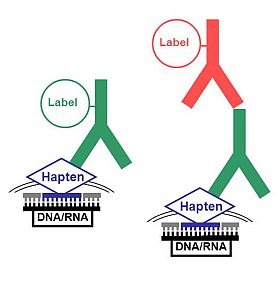
Besonders bewährt hat sich der Einsatz von anti-Hapten-Konjugaten zur Signalamplifizierung in der Fluoreszenz in situ Hybridisierung (FISH), vor allem bei Mehrfarbenmarkierungen mit unterschiedlichen Nukleinsäuresonden, die mit Haptenen, wie zum Beispiel Biotin, Digoxigenin oder Fluorescein konjugiert sind. In einer einfachen Verstärkung lassen sich haptenylierte Oligonukleotidsonden mit Konjugaten von anti-Hapten Antikörper markieren (Abb. li).
Oft ist jedoch eine doppelte Verstärkung notwendig: um das Signal zu erhöhen, können unkonjugierte anti-Hapten Antikörper verwendet und über einen fluoreszenzmarkierten Sekundärantikörper nachgewiesen werden (Abb. re). Eine zusätzliche Steigerung der Nachweisempfindlichkeit ist über den Einsatz eines fluorochromierten, gegen die Wirtsspezies des zweiten Antikörpers gerichteten Konjugates möglich.
Produktliste anti-Hapten-Konjugate für FISH
Literatur – Anwendungsbeispiele
Anti-FITC mit ABC/Biotin in Doppel-in situ-Hybridisierung
Dirks RW, van Gijlswijk RP, Tullis RH, Smit AB, van Minnen J, van der Ploeg M, Raap AK, 1990.
Simultaneous detection of different mRNA sequences coding for neuropeptide hormones by double in situ hybridization using FITC- and biotin-labeled oligonucleotides.
J Histochem Cytochem. 38(4), 467-73.
Anti-FITC in ELISA
Harmer IJ, Samuel D, 1989.
The FITC-anti-FITC system is a sensitive alternative to biotin-streptavidin in ELISA.
J Immunol Methods 122, 115-121.
Anti-Digoxin in Western Blot
Härtig W, Kacza J, Paulke BR, Grosche J, Bauer U, Hoffmann A, Elsinghorst PW, Gütschow M, 2010.
In vivo labelling of hippocampal beta-amyloid in triple-transgenic mice with a fluorescent acetylcholinesterase inhibitor released from nanoparticles.
Eur J Neurosci. 31(1), 99-109.
Anti-Digoxin in Western Blot-Analyse und IHC mit haptenylierten Antikörpern
Härtig W, Kirazov L, Brückner G, Holzer M, Gärtner U, Bigl V, 1997.
Blot analyses and immunocytochemistry of neural antigens with digoxigenylated primary and secondary antibodies.
Brain Res Brain Res Protoc. 2(1), 35-43.
Anti-Digoxin in IHC-Doppelmarkierung haptenylierter Primärantikörper
Härtig W, Brückner G, Holzer M, Brauer K, Bigl V, 1995.
Digoxigenylated primary antibodies for sensitive dual-peroxidase labelling of neuronal markers.
Histochem Cell Biol. 104(6), 467–472.
Anti-FITC mit Avidin/Biotin in IHC-Doppel- und Dreifachmarkierung monoklonaler Maus-Antikörper
Van der Loos CM, Das PK, Van den Oord JJ, Houthoff HJ, 1989.
Multiple immunoenzyme staining techniques. Use of fluoresceinated, biotinylated and unlabelled monoclonal antibodies.
J Immunol Methods 117, 45-52.
Anti-Biotin und anti-Digoxin in Immunfluoreszenz-Dreifachmarkierung
Härtig W, Brückner G, Brauer K, Seeger G, Bigl V, 1996.
Triple immunofluorescence labelling of parvalbumin, calbindin-D28k and calretinin in rat and monkey brain.
J Neurosci Methods. 67(2), 89-95.
Anti-Biotin vs. Streptavidin
Vincent P, Samuel D, 1993.
A comparison of the binding of biotin and biotinylated macromolecular ligands to an anti-biotin monoclonal antibody and to streptavidin.
J Immunol Methods. 165(2), 177-82.
